ადამიანის ბეტა-ამილოიდი (1-42) ცილა, რომელიც ასევე ცნობილია როგორც Aβ 1-42, არის მთავარი ფაქტორი ალცჰეიმერის დაავადების საიდუმლოებების გასახსნელად.ეს პეპტიდი ცენტრალურ როლს ასრულებს ამილოიდური დაფების, იდუმალი მტევნის წარმოქმნაში, რომლებიც აზიანებენ ალცჰეიმერის დაავადების მქონე პაციენტების ტვინს.დესტრუქციული ეფექტით, ის არღვევს ნეირონულ კომუნიკაციას, იწვევს ანთებას და იწვევს ნეიროტოქსიკურობას, რაც იწვევს კოგნიტურ დაქვეითებას და ნერვულ დაზიანებას.მისი აგრეგაციისა და ტოქსიკურობის მექანიზმების გამოკვლევა არა მხოლოდ სასიცოცხლოდ მნიშვნელოვანია;ეს არის ამაღელვებელი მოგზაურობა ალცჰეიმერის თავსატეხის გადაჭრისა და მომავალი თერაპიის განვითარებისკენ.



Aβ 1-42 არის 42 ამინომჟავის პეპტიდური ფრაგმენტი, რომელიც მიღებულია ამილოიდის წინამორბედი ცილის (APP) დაშლისგან β- და γ-სეკრეტაზებით.Aβ 1-42 არის ამილოიდური დაფების ერთ-ერთი მთავარი კომპონენტი, რომელიც გროვდება ალცჰეიმერის დაავადების მქონე პაციენტების ტვინში, ნეიროდეგენერაციული აშლილობა, რომელსაც ახასიათებს კოგნიტური დაქვეითება და მეხსიერების დაქვეითება.ნაჩვენებია, რომ Aβ 1-42-ს აქვს სხვადასხვა ფუნქციები და გამოყენება ბიოლოგიურ და ბიოსამედიცინო კვლევებში, როგორიცაა:
1. ნეიროტოქსიკურობა: Aβ 1-42-ს შეუძლია შექმნას ხსნადი ოლიგომერები, რომლებსაც შეუძლიათ შებოჭონ და დაარღვიონ ნეირონების მემბრანების, რეცეპტორების და სინაფსების ფუნქციები.ამ ოლიგომერებს ასევე შეუძლიათ გამოიწვიონ ოქსიდაციური სტრესი, ანთება და აპოპტოზი ნეირონებში, რაც იწვევს სინაფსურ დაკარგვას და ნეირონების სიკვდილს.Aβ 1-42 ოლიგომერები მიჩნეულია უფრო ნეიროტოქსიკურად, ვიდრე Aβ-ის სხვა ფორმები, როგორიცაა Aβ 1-40, რომელიც არის Aβ-ის ყველაზე გავრცელებული ფორმა ტვინში.ითვლება, რომ Aβ 1-42 ოლიგომერებს ასევე შეუძლიათ უჯრედიდან უჯრედში გავრცელება, პრიონების მსგავსად, და გამოიწვიოს სხვა ცილების არასწორი დაკეცვა და აგრეგაცია, როგორიცაა ტაუ, რომელიც აყალიბებს ნეიროფიბრილარულ კვანძებს ალცჰეიმერის დაავადების დროს.
Aβ 1-42 ფართოდ განიხილება, როგორც Aβ იზოფორმა უმაღლესი ნეიროტოქსიკურობით.რამდენიმე ექსპერიმენტულმა კვლევამ აჩვენა Aβ 1-42-ის ნეიროტოქსიკურობა სხვადასხვა მეთოდებისა და მოდელების გამოყენებით.მაგალითად, ლესნე და სხვ.(ტვინი, 2013) გამოიკვლია Aβ ოლიგომერების წარმოქმნა და ტოქსიკურობა, რომლებიც წარმოადგენენ Aβ მონომერების ხსნად აგრეგატებს და აჩვენა, რომ Aβ 1-42 ოლიგომერებს აქვთ უფრო ძლიერი დამაზიანებელი ეფექტი ნეირონების სინაფსებზე, რაც იწვევს კოგნიტურ დაქვეითებას და ნეირონების დაკარგვას.ლამბერტი და სხვ.(მეცნიერებათა ეროვნული აკადემიის შრომები, 1998) ხაზგასმით აღნიშნეს Aβ 1-42 ოლიგომერების ნეიროტოქსიკურობა და დაადგინეს, რომ მათ აქვთ ძლიერი ტოქსიკური მოქმედება ცენტრალურ ნერვულ სისტემაზე, შესაძლოა სინაფსებზე და ნეიროტრანსმიტერებზე ზემოქმედებით.უოლში და სხვ.(Nature, 2002) აჩვენა Aβ 1-42 ოლიგომერების ინჰიბიტორული ეფექტი ჰიპოკამპის ხანგრძლივ გაძლიერებაზე (LTP) in vivo, რომელიც არის უჯრედული მექანიზმი, რომელიც ემყარება სწავლასა და მეხსიერებას.ეს დათრგუნვა დაკავშირებული იყო მეხსიერების და სწავლის დაქვეითებასთან, რაც ხაზს უსვამს Aβ 1-42 ოლიგომერების გავლენას სინაფსურ პლასტიურობაზე.შანკარი და სხვ.(Nature Medicine, 2008) გამოყო Aβ 1-42 დიმერები პირდაპირ ალცჰეიმერის ტვინიდან და აჩვენა მათი გავლენა სინაფსურ პლასტიურობასა და მეხსიერებაზე, რაც უზრუნველყოფს ემპირიულ მტკიცებულებას Aβ 1-42 ოლიგომერების ნეიროტოქსიკურობის შესახებ.
გარდა ამისა, სუ და სხვ.(Molecular & Cellular Toxicology, 2019) ჩაატარა Aβ 1-42-ით გამოწვეული ნეიროტოქსიკურობის ტრანსკრიპტომიური და პროტეომიკური ანალიზი SH-SY5Y ნეირობლასტომის უჯრედებში.მათ დაადგინეს რამდენიმე გენი და ცილა, რომლებზეც Aβ 1-42 გავლენას ახდენდა აპოპტოზურ პროცესთან, ცილების ტრანსლაციასთან, cAMP კატაბოლურ პროცესთან და ენდოპლაზმური რეტიკულუმის სტრესის რეაქციასთან დაკავშირებული გზებით.ტაკედა და სხვ.(ბიოლოგიური კვალი ელემენტების კვლევა, 2020) გამოიკვლია უჯრედგარე Zn2+-ის როლი Aβ 1-42-ით გამოწვეულ ნეიროტოქსიკურობაში ალცჰეიმერის დაავადებაში.მათ აჩვენეს, რომ Aβ 1-42-ით გამოწვეული უჯრედშიდა Zn2+ ტოქსიკურობა დაჩქარებული იყო დაბერებასთან ერთად, ასაკთან დაკავშირებული ზრდის გამო უჯრედგარე Zn2+.მათ ვარაუდობდნენ, რომ Aβ 1-42, რომელიც მუდმივად გამოიყოფა ნეირონების ტერმინალებიდან, იწვევს ასაკთან დაკავშირებულ კოგნიტურ დაქვეითებას და ნეიროდეგენერაციას უჯრედშიდა Zn2+ დისრეგულაციის გზით.ეს კვლევები ვარაუდობენ, რომ Aβ 1-42 არის ძირითადი ფაქტორი ალცჰეიმერის დაავადების დროს ნეიროტოქსიკურობისა და დაავადების პროგრესირების შუამავლობაში, ტვინში სხვადასხვა მოლეკულურ და ფიჭურ პროცესებზე ზემოქმედებით.
2. ანტიმიკრობული აქტივობა: ცნობილია, რომ Aβ 1-42-ს აქვს ანტიმიკრობული მოქმედება სხვადასხვა პათოგენების მიმართ, როგორიცაა ბაქტერიები, სოკოები და ვირუსები.Aβ 1-42-ს შეუძლია მიბმა და დაარღვიოს მიკრობული უჯრედების მემბრანები, რაც იწვევს მათ ლიზისს და სიკვდილს.Aβ 1-42 ასევე შეუძლია გაააქტიუროს თანდაყოლილი იმუნური სისტემა და მოახდინოს ანთებითი უჯრედები ინფექციის ადგილზე.ზოგიერთმა კვლევამ აჩვენა, რომ ტვინში Aβ-ის დაგროვება შეიძლება იყოს დამცავი პასუხი ქრონიკული ინფექციების ან დაზიანებების მიმართ.თუმცა, Aβ-ის გადაჭარბებულმა ან არარეგულირებულმა გამომუშავებამ შეიძლება გამოიწვიოს მასპინძელი უჯრედების და ქსოვილების კოლატერალური დაზიანება.
ცნობილია, რომ Aβ 1-42 ავლენს ანტიმიკრობულ აქტივობას სხვადასხვა პათოგენების მიმართ, როგორიცაა ბაქტერიები, სოკოები და ვირუსები, როგორიცაა Staphylococcus aureus, Escherichia coli, Candida albicans და Herpes simplex ვირუსის ტიპი 1, მათ მემბრანებთან ურთიერთქმედებით და იწვევს მათ მოშლას და ლიზისს.კუმარი და სხვ.(Journal of Alzheimer's Disease, 2016) აჩვენა ეს ეფექტი იმით, რომ Aβ 1-42 ცვლის მიკრობული უჯრედების მემბრანის გამტარიანობას და მორფოლოგიას, რამაც გამოიწვია მათი სიკვდილი.გარდა პირდაპირი ანტიმიკრობული მოქმედებისა, Aβ 1-42-ს შეუძლია ასევე მოახდინოს თანდაყოლილი იმუნური პასუხის მოდულირება და ანთებითი უჯრედების გადაყვანა ინფექციის ადგილზე.სოსცია და სხვ.(PLoS One, 2010) გამოავლინა ეს როლი მოხსენებით, რომ Aβ 1-42 ასტიმულირებს ანთების პრო-ანთებითი ციტოკინების და ქიმიოკინების გამომუშავებას, როგორიცაა ინტერლეიკინ-6 (IL-6), სიმსივნის ნეკროზის ფაქტორი-ალფა (TNF-α), მონოციტები. ქიმიოტრაქტანტი ცილა-1 (MCP-1) და მაკროფაგის ანთებითი პროტეინი-1 ალფა (MIP-1α), მიკროგლიაში და ასტროციტებში, თავის ტვინის მთავარ იმუნურ უჯრედებში.
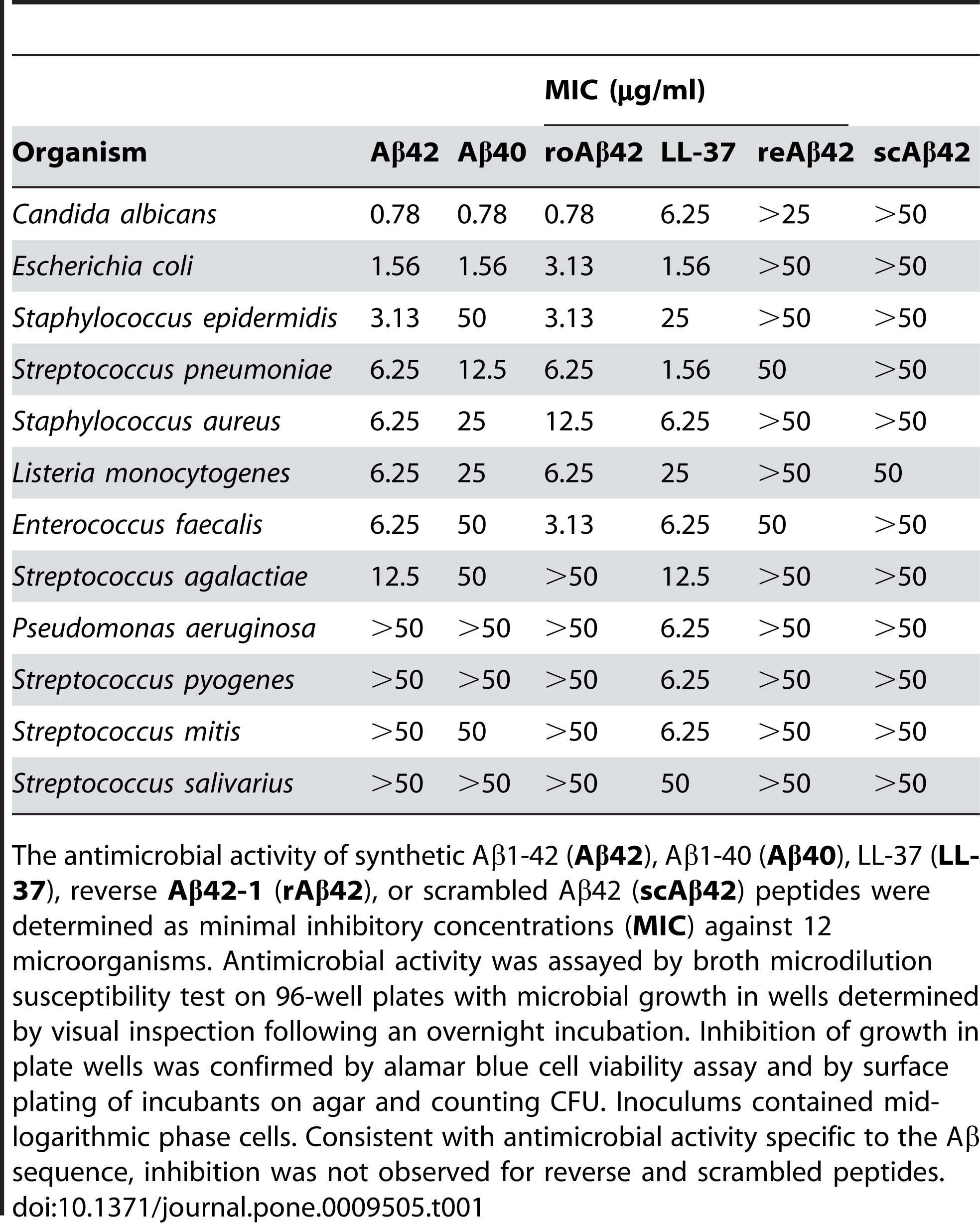
სურათი 2. Aβ პეპტიდებს გააჩნიათ ანტიმიკრობული აქტივობა.
(Soscia SJ, Kirby JE, Washicosky KJ, Tucker SM, Ingelsson M, Hyman B, Burton MA, Goldstein LE, Duong S, Tanzi RE, Moir RD. ალცჰეიმერის დაავადებასთან ასოცირებული ამილოიდური ბეტა-პროტეინი არის ანტიმიკრობული პეპტიდი. PLoS One . 2010 მარტი 3;5(3):e9505.)
მიუხედავად იმისა, რომ ზოგიერთმა კვლევამ აჩვენა, რომ ტვინში Aβ-ის დაგროვება შეიძლება იყოს დამცავი პასუხი ქრონიკული ინფექციების ან დაზიანებების მიმართ, რადგან Aβ შეუძლია იმოქმედოს როგორც ანტიმიკრობული პეპტიდი (AMP) და აღმოფხვრას პოტენციური პათოგენები, Aβ და მიკრობული ელემენტების რთული ურთიერთქმედება რჩება. გამოძიების თემა.დელიკატური ბალანსი ხაზგასმულია Moir et al.(ალცჰეიმერის დაავადების ჟურნალი, 2018), რომელიც ვარაუდობს, რომ დისბალანსი ან გადაჭარბებული Aβ გამომუშავება შეიძლება უნებლიედ დააზიანოს მასპინძელი უჯრედები და ქსოვილები, რაც ასახავს Aβ-ის როლის რთულ ორმაგ ბუნებას ინფექციასა და ნეიროდეგენერაციაში.Aβ-ის გადაჭარბებულმა ან არარეგულარულმა გამომუშავებამ შეიძლება გამოიწვიოს მისი აგრეგაცია და დეპონირება ტვინში, ტოქსიკური ოლიგომერების და ფიბრილების წარმოქმნით, რომლებიც აზიანებენ ნეირონების ფუნქციას და იწვევენ ნეიროანთებას.ეს პათოლოგიური პროცესები ასოცირდება კოგნიტურ დაქვეითებასთან და მეხსიერების დაქვეითებასთან ალცჰეიმერის დაავადების დროს, ნეიროდეგენერაციული აშლილობა, რომელსაც ახასიათებს პროგრესირებადი დემენცია.ამიტომ, ბალანსი Aβ-ის სასარგებლო და მავნე ეფექტებს შორის გადამწყვეტია ტვინის ჯანმრთელობის შენარჩუნებისა და ნეიროდეგენერაციის თავიდან ასაცილებლად.
3.რკინის ექსპორტი: ნაჩვენებია, რომ Aβ 1-42 მონაწილეობს ტვინში რკინის ჰომეოსტაზის რეგულირებაში.რკინა აუცილებელი ელემენტია მრავალი ბიოლოგიური პროცესისთვის, მაგრამ ჭარბმა რკინამ ასევე შეიძლება გამოიწვიოს ოქსიდაციური სტრესი და ნეიროდეგენერაცია.Aβ 1-42 შეიძლება დაუკავშირდეს რკინას და ხელი შეუწყოს მის ექსპორტს ნეირონებიდან ფეროპორტინის საშუალებით, რკინის ტრანსმემბრანული გადამტანი.ეს შეიძლება დაეხმაროს თავის ტვინში რკინის დაგროვებისა და ტოქსიკურობის თავიდან აცილებას, რადგან ჭარბმა რკინამ შეიძლება გამოიწვიოს ოქსიდაციური სტრესი და ნეიროდეგენერაცია.დუჩე და სხვ.(Cell, 2010) იტყობინება, რომ Aβ 1-42 უკავშირდება ფეროპორტინს და ზრდის მის ექსპრესიას და აქტივობას ნეირონებში, რაც იწვევს უჯრედშიდა რკინის დონის შემცირებას.მათ ასევე აჩვენეს, რომ Aβ 1-42 ამცირებს ჰეპციდინის, ჰორმონის, რომელიც აფერხებს ფეროპორტინს, ექსპრესიას ასტროციტებში, რაც კიდევ უფრო აძლიერებს რკინის ექსპორტს ნეირონებიდან.თუმცა, რკინით შეკრული Aβ შესაძლოა უფრო მიდრეკილი გახდეს უჯრედგარე სივრცეში აგრეგაციისა და დეპონირებისკენ, ამილოიდური დაფების წარმოქმნით.აიტონი და სხვ.(Journal of Biological Chemistry, 2015) იტყობინება, რომ რკინა ხელს უწყობს Aβ ოლიგომერების და ფიბრილების წარმოქმნას in vitro და in vivo.მათ ასევე აჩვენეს, რომ რკინის ჩელაცია ამცირებს Aβ აგრეგაციას და დეპონირებას ტრანსგენურ თაგვებში.ამრიგად, რკინის ჰომეოსტაზზე Aβ 1-42-ის სასარგებლო და მავნე ეფექტებს შორის ბალანსი გადამწყვეტია ტვინის ჯანმრთელობის შენარჩუნებისა და ნეიროდეგენერაციის თავიდან ასაცილებლად.
ჩვენ ვართ პოლიპეპტიდების მწარმოებელი ჩინეთში, პოლიპეპტიდების წარმოებაში რამდენიმე წლიანი გამოცდილებით.Hangzhou Taijia Biotech Co., Ltd. არის პროფესიონალური პოლიპეპტიდური ნედლეულის მწარმოებელი, რომელსაც შეუძლია უზრუნველყოს ათობით ათასი პოლიპეპტიდური ნედლეული და ასევე შეიძლება მორგებული იყოს საჭიროებების მიხედვით.პოლიპეპტიდური პროდუქტების ხარისხი შესანიშნავია, ხოლო სისუფთავე შეიძლება მიაღწიოს 98%-ს, რაც აღიარებულია მომხმარებლების მიერ მთელ მსოფლიოში. კეთილი იყოს თქვენი მობრძანება ჩვენთან.






